POLÍMEROS
quinta-feira, 18 de novembro de 2010
Polímeros
Tamile Almeida , Verena Goes, Vanessa moreira, Bruna Ribeiro, Ermindo Silva, Ismael Borges
Substituição de Polímero
POSTADO POR TAMILE ALMEIDA
"Substituição de polímero em processo de obtenção de vidros laminados compostos resistentes à balas". Especialmente de um método através do qual torna-se possível a substituição de policarbonato na obtenção de vidros curvos ou planos do tipo laminados resistentes à balas. Em linhas gerais, consiste a invenção na substituição das placas de policarbonato - um plástico transparente definido como termoplástico - e filme de poliuretano, atualmente utilizados pôr fabricantes de vidros blindados, pôr filme/placa de resina ionomérica (plástico transparente), também definido como termoplástico e que possui a propriedade de aderir ao vidro. Composto pôr uma pluralidade de placas de vidro (1) intercaladas com pvb - polivinil butiral (2) e filme/placa de resina ionomérica (3), sendo a última camada formada por 'spall shield' (4)
RECICLAGEM
POSTADOR POR TAMILE ALMEIDA
Esses EarthShips são construídos com materiais de acordo com a localidade, para oferecer assim maior conforto com relação a temperaturas e maior resistência quando necessário. As paredes da casa são construídas a base de borracha de pneus preenchidos com adobe (terra, água e palha) e compactados. Esses pneus preenchidos são empilhados de modo a gerar as paredes da casa. Entre os pneus, utiliza-se adobe e/ou massa (com cimento) para que esses se mantenham unidos.
Esses EarthShips são construídos com materiais de acordo com a localidade, para oferecer assim maior conforto com relação a temperaturas e maior resistência quando necessário. As paredes da casa são construídas a base de borracha de pneus preenchidos com adobe (terra, água e palha) e compactados. Esses pneus preenchidos são empilhados de modo a gerar as paredes da casa. Entre os pneus, utiliza-se adobe e/ou massa (com cimento) para que esses se mantenham unidos.
quarta-feira, 27 de outubro de 2010
Estrutura Molecular dos Polímeros
POSTADO POR VANESSA MOREIRA
Dependendo da natureza química dos monômeros e da técnica empregada para a polimerização, os polímeros podem exibir diferentes tipos de arquiteturas. Os mais comuns são os de estrutura linear, ramificada ou em rede. A primeira figura, ilustra o polietileno de alta densidade (HDPE): uma molécula de cadeia longa elinear, feita pela polimerização do etileno, um composto cuja fórmula estrutural é CH2=CH2.
A indústria também produz uma outra variedade de polietileno, que possui cadeias ramificadas. Este é conhecido como polietileno de baixa densidade (LDPE), e esta ilustrado na figura abaixo. O impedimento espacial provocado pelas ramificações dificulta um "empilhamento" das cadeias poliméricas. Por esta razão, as forças intermoleculares que mantém as cadeias poliméricas unidas tendem a ser mais fracas em polímeros ramificados. Por isso o LDPE é bastante flexível e pode ser utilizado como filme plástico para embalagens, enquanto que o HDPE é bastante duro e resistente, sendo utilizado em garrafas, brinquedos, etc..
A figura seguinte mostra um polímero cujas cadeias estão entrelaçadas numa complexa rede de ligações covalentes. O exemplo da figura é a resina fenolformaldeído, onde moléculas de fenol são unidas pelo formaldeído.
Embora o primeiro polímero sintético só tenha sido obtido em 1907, hoje os plásticos já estão onipresentes em nosso cotidiano. Muitos dos utensílios domésticos, automóveis, embalagens e até mesmo roupas, são feitas com polímeros.
Polímeros biológicos fundamentam a existência da vida, e existem desde o surgimento da primeira
célula na superfície da terra.
Os polímeros naturais têm sido empregados pelo homem desde os mais remotos tempos: asfalto era utilizado em tempos pré-bíblicos; âmbar já era conhecido pelos gregos e a goma pelos romanos. Os polímeros sintéticos, porém, somente surgiram no último século.
Um grande marco na história da indústria de plásticos foi a descoberta do processo de vulcanização da borracha em 1839 (a partir do látex, um polímero natural, que já era largamente empregado) pela Goodyear. O próximo grande passo foi a nitração da celulose, resultando na nitrocelulose, produto comercializado primeiramente por Hyatt, em 1870.
Ano de Introdução de Alguns Polímeros no Mercado
terça-feira, 26 de outubro de 2010
CURIOSIDADES
POSTADO POR ERMINDO SILVA
PROBLEMAS AMBIENTAIS
A utilização de embalagens plásticas é um dos grandes problemas ambientais que obstruem redes de drenagem, sedimentam-se no fundo dos rios, retardam a biodigestão nos aterros sanitários e poluem os oceanos comprometendo a vida marinha. Creio que é hora de adotar de forma firme e definitiva os pPrincípios ambientais do “Poluidor-Pagador” ou do “Gerador-Pagador”.
Consumimos milhões de litros de água mineral, refrigerantes e tantos outros produtos que geram outros tantos milhões de embalagens despejadas nas ruas, rios, florestas e oceanos. A utilização de embalagens produzidas a partir de polímeros não imputa aos geradores ou fabricantes (Coca-Cola, Pepsi, Ambev, etc.) pagamento qualquer pelos passivos ambientais gerados nem são cobrados os custos ou lhe são taribuídas responsabilidades pelo tratamento ou recolhimento para reciclagem.
RECICLAGEM (DE POLIMEROS DE ADIÇAO:POLIETILENO :GARRAFAS)
À primeira vista, muitas pessoas perguntaram se dava para sentar, desconfiando de sua resistência. O bacana dessa peça é que ela é, sim, funcional e agüenta o peso de um adulto muito bem.
O IMPACTO NO MEIO AMBIENTE
O isopor é um produto sintético proveniente do petróleo e deriva da natureza, tal como o vidro, a cerâmica e os metais.
Na natureza o isopor leva 150 anos para ser degradado, conforme estimativas. Na natureza, pelotas de isopor são confundidas com organismos marinhos, como o plástico, e ingeridas por cetáceos e peixes, afetando-lhes o sistema digestivo.
Na natureza o isopor leva 150 anos para ser degradado, conforme estimativas. Na natureza, pelotas de isopor são confundidas com organismos marinhos, como o plástico, e ingeridas por cetáceos e peixes, afetando-lhes o sistema digestivo.
Hoje já temos várias formas de reciclar o poliestireno expandido, também conhecido como Isopor .
UTILIDADES NA ECONOMIA
O projeto foi elaborado por José Alcino Alano e família, em Tubarão/SC. A idéia é contribuir com a preservação do meio ambiente, criando uma solução prática e econômica para que materiais como as garrafas PET e as caixas Tetra Pak, ambas difíceis de se decomporem na natureza, sejam reciclados e tragam mais conforto a famílias de baixa renda.
domingo, 24 de outubro de 2010
OS POLÍMEROS DE FORMA DETALHADA
POSTADO POR BRUNA RIBEIRO
Polímeros (do grego polys = muitos). Segundo Berzelius (1833), um composto químico B é polímero de outro composto A, quando B tem a mesma fórmula mínima que A (são isômeros) e tem a fórmula molecular múltipla da de A. O peso molecular de B é também múltiplo do de A, e na mesma proporção. Exemplos:
Nesta definição de polímero, Berzelius não incluiu a idéia de que o polímero B devesse ser obtido a partir do composto A, de peso molecular menor.
E este foi o primeiro conceito de polímero, que será, freqüentemente, citado pelos idealizadores dos novos conceitos de polímero, como: Staudinger, Carothers e Flory.
Nenhum destes três neologismos criados por Berzelius (isômero, metâmero e polímero) conservou o significado original.
Hoje, isômeros são compostos diferentes de igual fórmula molecular. São os metâmeros de Berzelius.
Metâmeros são hoje um determinado tipo de isômeros estruturais. São os isômeros de com- pensação. Exemplo: acetato de vinila e acrilato de metila.
E o vocábulo polímero mudou de significado três vezes, desde aquele tempo, conforme se verá a continuação.
4. POLÍMEROS DE CONDENSAÇÃO
Por volta de 1930 e graças, principalmente, aos numerosos e minuciosos trabalhos de Carothers, o conceito de polímero foi, novamente, modificado e ampliado, adquirindo a forma atual.
Segundo Carothers, polímero é um composto químico de peso molecular elevado, formado por muitas moléculas pequenas, iguais ou de vários tipos diferentes, unidas umas a outras por ligações covalentes, resultantes de muitas reações de adição ou de condensação (substituição) consecutivas.
Quando só ocorrem reações de adição, não há perda de matéria, não há subprodutos e, por conseguinte, o peso molecular de uma molécula de polímero é igual à soma dos pesos mole- culares de todas as moléculas dos monômeros que a formaram.
Mas, se ocorrem reações de condensação (substituição), há perda de matéria, há formação de subprodutos, desprendem-se moléculas pequenas, tais como: água, metanol, cloreto de hidrogênio, etc. Daí que o peso molecular de uma molécula de polímero seja menor que a soma dos pesos moleculares de todas as moléculas dos monômeros que a formaram. A diferença corresponde ao subproduto.
Por isto, a composição centesimal de um polímero obtido por reações de condensação é sempre diferente da composição centesimal dos monômeros, mesmo que se trate de um homopolímero.
Este conceito de polímero se afasta de vez da definição original de Berzelius.
Os monômeros, para poder dar reações de condensação, devem ter determinados grupos funcionais ou átomos, tais como: carboxila, hidroxila (alcoólica ou fenólica), éster, carbonila, amina, halogênio, hidrogênio ativo, etc.
Exemplo 10.
Monômero: Ácido 11-aminoundecanóico = Ácido -aminoundecanóico.
n HNH–(CH2)10–COOH —— H–[NH–(CH2)10–CO]n–OH + (n-1) H2O
Exemplo 11.
Monômero: -D-Glicopiranose.
Polímero: Poli(1,4--D-Glicopiranose) = Celulose.
Exemplo 12.
Monômeros: Ácido adípico e glicol etilênico.
Polímero: Poli(adipato de etileno).
n HOCO–(CH2)4–COOH + n HO–(CH2)2–OH ——
HO–[CO–(CH2)4–CO—O–(CH2)2–O]n–H + (2n-1) H2O
Exemplo 13.
Monômeros: p-terc-Butilfenol e formaldeído.
Polímero: Resina fenol-formaldeído tipo Novolaca.
Exemplo 14.
Monômeros: Bisfenol A e fosgênio.
Polímero: Poli(carbonato de 4,4'-difenil-isopropilideno) = PC.
Exemplo 15.
Monômeros: Sulfeto de sódio e p-diclorobenzeno.
Polímero: Poli(sulfeto de p-fenileno) = PPS (Poly(p-phenylene sulfide)).
Nos exemplos 10-15, as moléculas dos monômeros se unem entre si para formar os polímeros por reações de condensação (substituição), com desprendimento de moléculas pequenas (água, cloreto de hidrogênio, cloreto de sódio).
Este tipo de polimerização se denomina polimerização por condensação ou policondensação.
Os exemplos 10-11 são de homopolímeros de condensação e os exemplos 12-15 são de copolímeros de condensação.
Os polímeros de condensação receberam esta denominação de Carothers, a qual tinha sido dada, anteriormente, a outro tipo de polímeros por Staudinger.
Talvez, a palavra condensação não foi bem escolhida. É que, em química, condensação é um vocábulo ambíguo porque tanto pode ser uma reação de adição (condensação aldólica, con- densação benzoínica) quanto uma reação de substituição (condensação de Claisen, condensação de Perkin).
Por isto, deve levar-se em conta que, no caso dos polímeros de condensação, essa reação de condensação é uma reação de substituição. Daí que se forme um subproduto.
As que não dão lugar a dúvida são as denominações dos quatro tipos principais de reações da química orgânica: adição, eliminação, substituição e isomerização.
5. CLASSIFICAÇÕES DOS POLÍMEROS E DAS POLIMERIZAÇÕES
Polimerização é a formação de polímeros. É o conjunto de reações químicas intermoleculares, segundo o qual, as moléculas dos monômeros se unem umas a outras, por ligações covalentes, para formar polímeros.
Uma característica fundamental da polimerização, ressaltada por Carothers em 1936, é "a peculiaridade de ser funcionalmente capaz de poder prosseguir indefinidamente levando à obtenção de polímeros de peso molecular, teoricamente, infinito".
Na realidade, a polimerização se interrompe por diversos motivos: esgotamento do monômero, estequiometria desbalanceada, reação de um polímero em crescimento com uma molécula monofuncional ou com outro polímero em crescimento, viscosidade excessiva do meio, etc.
O termo polimerização foi utilizado, pela primeira vez, em 1866, por Berthelot, que o aplicou à obtenção de um poliestireno gelatinoso.
Há vários tipos de polímeros e de polimerizações. Há várias classificações de polímeros e de polimerizações.
A primeira classificação dos polímeros foi feita por Carothers, em 1929, baseando-se em dois critérios interdependentes: a relação entre as composições centesimais de polímero e monômero, e a formação ou não formação de subprodutos. Carothers dividiu os polímeros em dois grupos: polímeros de adição e polímeros de condensação.
Os polímeros de adição se obtêm por polimerização por adição ou poliadição, e se carac- terizam pelo seguinte:
Os polímeros de condensação se obtêm por polimerização por condensação ou policon- densação, e se caracterizam pelo seguinte:
A segunda classificação dos polímeros foi feita baseando-se na estrutura química da cadeia principal, deduzida observando as características dos polímeros da classificação de Carothers.
Uma classificação das polimerizações foi feita por Flory, em 1953, baseando-se nos meca- nismos das reações de polimerização, que são muito diferentes e importantes. Flory dividiu as polimerizações em dois grupos: polimerização em cadeia e polimerização em etapas.
A polimerização em cadeia se caracteriza pelo seguinte:
Do que foi dito, não se deve deduzir que a polimerizacão em cadeia é mais rápida que a polimerização em etapas. O que é muito mais rápida é a formação individual de cada molécula de polímero. Mas, as velocidades de desaparecimento do monômero e da polimerização global são semelhantes.
As classificações de Carothers e de Flory não são antagônicas, pelo contrário, complementam-se entre si. São maneiras diferentes de examinar o mesmo fenômeno. Partindo de elas, pode fazer-se uma nova classificação dos polímeros, dividindo-os nos quatro grupos seguintes:
1. Os polímeros de adição obtidos por polimerização em cadeia têm as características seguintes:
2. Os polímeros de condensação obtidos por polimerização em etapas têm as características seguintes:
Exemplos 10-15.
3. Os polímeros de adição obtidos por polimerização em etapas.
Quase todos os polímeros podem classificar-se, facilmente, em algum dos dois grupos ante- riores. Mas, existem uns poucos polímeros importantes que não encaixam bem em nenhum deles.
São polímeros que se formam por adição de um monômero a uma ligação dupla ou a um ciclo de outro monômero diferente, sem eliminação de um subproduto (como nas poliadições), mas a polimerização não ocorre por uma reação em cadeia (como nas poliadições) e sim por uma reação em etapas (como nas policondensações).
Estes polímeros, intermediários entre os dos grupos 1 e 2, têm as características seguintes:
Exemplo 16.
Monômeros: Diálcool e diisocianato.
Polímero: Poliuretano.
(n+1) HO–R–OH + n O=C=N–R'–N=C=O ——
H–[O–R–O—CO–NH–R'–NH–CO]n–O–R–OH
Exemplo 17.
Monômeros: Diamina e diisocianato.
Polímero: Poliuréia.
(n+1) HHN–R–NHH + n O=C=N–R'–N=C=O ——
H–[HN–R–NH—CO–NH–R'–NH–CO]n–HN–R–NHH
Exemplo 18.
Monômeros: Diamina e resina diepoxídica.
Polímero: Resina diepoxídica curada (fragmento linear idealizado).
H–[HN–R–NH—CH2–CHOH–CH2–R'–CH2–CHOH–CH2]n–HN–R–NHH
4. Os polímeros que se podem obter por polimerização em cadeia e, também, por poli- merização em etapas.
São polímeros que podem ser incluídos no grupo 1, e, também, no grupo 2, dependendo dos monômeros utilizados.
Exemplo 19.
O nylon-6 pode ser um polímero de adição obtido por polimerização em cadeia a partir da 6-caprolactama (exemplo 6), e pode ser, também, um polímero de condensação obtido por polimerização em etapas a partir do ácido 6-aminocapróico (NH2–(CH2)5–COOH), com desprendimento de água (como no exemplo 10).
Exemplo 20.
O polioxietileno pode ser um polímero de adição obtido por polimerização em cadeia a partir de óxido de etileno (exemplo 5), e pode ser, também, um polímero de condensação obtido por polimerização em etapas a partir do glicol etilênico (HO–(CH2)2–OH), com formação de água.
6. UNIDADES ESTRUTURAIS E UNIDADES PERIÓDICAS
Unidade estrutural de um monômero é a porção do monômero que entra a fazer parte da cadeia do polímero.
Nos monômeros que dão poliadições, a unidade estrutural é o próprio monômero inteiro ou, por melhor dizer, uma forma resonante do monômero, porque a única diferença entre a unidade estrutural e o monômero é a posição de dois elétrons procedentes da excisão de uma ligação covalente. Exemplos:
Nos monômeros que dão policondensações, a unidade estrutural é o monômero menos os átomos que perde, na reação de condensação, para formar o produto secundário. Exemplos:
Unidade periódica de um polímero, também denominada unidade repetida ou unidade que se repete, é a unidade estrutural de um monômero ou as unidades estruturais de vários monômeros, que se repetem, periodicamente, ao longo da cadeia do polímero.
Nos homopolímeros, sejam de adição ou de condensação, as unidades estrutural do monômero e periódica do polímero são idênticas, ou seja, a unidade periódica é a própria unidade estrutural. Exemplos 1-6, 10-11 e 19-20.
Nos copolímeros de adição (raros) e nos de condensação (numerosos) formados por dois monômeros diferentes que se situam, alternadamente, na cadeia do polímero, há duas unidades estruturais diferentes (uma de cada monômero), que, juntas, constituem a unidade periódica do polímero.
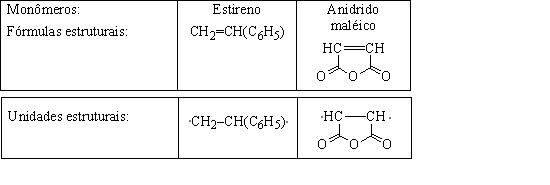
Exemplo 21.
Polímero: Poli(estireno-anidrido maléico).
Exemplo 22.
Polímero: Poli(hexametilenoadipamida) = Nylon-6,6 = Poliamida-6,6
Unidade periódica: ·NH(CH2)6HN:CO(CH2)4CO·
n H:NH(CH2)6HN:H + n HO:CO(CH2)4CO:OH ——
H–[NH(CH2)6HN:CO(CH2)4CO]n–OH + (2n-1) H2O
Nos copolímeros de adição formados por dois monômeros diferentes não alternados, as uni- dades estruturais dos monômeros são sempre claramente identificáveis, mas a unidade periódica do polímero se torna aproximada, média, estatística. Exemplos 7-9.
Nos copolímeros, tanto de adição como de condensação, quando o número de comonômeros é superior a dois, também são evidentes as unidades estruturais dos monômeros, mas a unidade periódica do polímero é estatística e difícil de delimitar.
Nos polímeros de adição obtidos por polimerização em etapas, há uma diferença importante em relação às unidades estruturais dos monômeros. É que dois átomos de hidrogênio são transferidos de um monômero para o outro. Portanto, a unidade estrutural do primeiro monômero tem dois átomos de hidrogênio menos que monômero, e a do segundo, tem dois mais. Com isto, os átomos da unidade periódica do polímero são, exatamente, a soma dos átomos dos dois monômeros (como nas poliadições). Exemplos 16-18.
Alguns autores denominam unidade estrutural do polímero à unidade periódica. Assim, a expressão "unidade estrutural" pode referir-se ao monômero ou ao polímero, infelizmente.
Os polímeros lineares (todos os considerados neste artigo; exemplos 1-22) são representados levando em conta as unidades estruturais e as periódicas. Para que a representação seja correta, devem fixar-se, exatamente, os limites de ditas unidades, ou seja, onde começam e onde terminam. Os colchetes que demarcam as unidades periódicas dos polímeros devem estar colocados, exatamente, nos limites destas unidades. Infelizmente, muitos livros sérios e outras publicações sobre polímeros descuidam este importante ponto.
Quando se representam os polímeros de adição, é usual escrever apenas a unidade periódica, entre colchetes, e um "n" como subíndice referente ao grau de polimerização, sem indicar os grupos extremos da cadeia. Isto porque tais grupos poucas vezes se conhecem e não se podem deduzir a partir dos monômeros. O grupo extremo inicial do polímero depende do iniciador utilizado, e o extremo final, do tipo de reação de terminação. Exemplos 1-9 e 21.
Quando se representam os polímeros de condensação, é correto usar o mesmo sistema dos polímeros de adição. Porém, é mais conveniente, talvez, indicar também os grupos extremos porque, neste caso, são bem conhecidos, dado que são os grupos funcionais dos monômeros. Exemplos 10-15 e 22.
Para os polímeros de adição obtidos por polimerização em etapas, vale o dito para os polímeros de condensação. Exemplos 16-18.
Reações de Condensação e Adição
POSTADO POR VERENA GOES
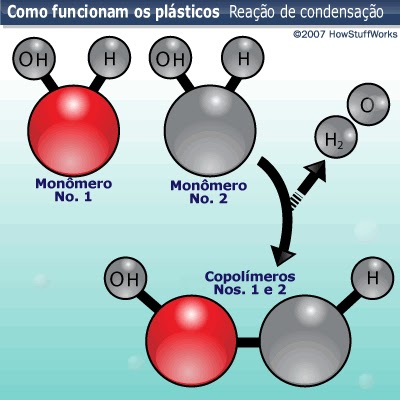
Existem algumas maneiras de se combinar monômeros para formar os polímeros de plásticos. Um dos métodos é um tipo de reação química chamada reação de condensação. Em uma reação de condensação, duas moléculas se combinam com a perda de uma menor, geralmente de água, um alcool ou ácido. Para compreender as reações de condensação, vejamos outra reação hipotética de polímeros.
Os monômeros 1 e 2 possuem grupos de hidrogênio (H) e hidroxila (OH) anexados a eles. Quando eles se juntam a um catalizador adequado (um átomo ou uma molécula que acelera a reação química sem se dissolver), um monômero perde um hidrogênio e o outro perde um grupo de hidroxila. O hidrogênio e os grupos de hidroxila, por sua vez, combinam-se para formar a água (H2O) e os elétrons remanescentes formam uma ligação química covalente entre os monômeros. O composto resultante é a subunidade básica dos copolímeros 1 e 2. Essa reação ocorre repetidamente, até que se forme uma longa cadeia de copolímeros 1 e 2.
Outra maneira de combinação dos monômeros para formar copolímeros é através de reações de adição. As reações de adição envolvem a reorganização de elétrons das ligações duplas dentro de um monômero para formar ligações únicas com outras moléculas. Imagine que duas pessoas (cada uma representando um monômero) estão próximas e cada uma está com os braços cruzados (ligação dupla). Em seguida, eles descruzam os braços e se dão as mãos (ligação única). Essas pessoas estão formando um polímero, e o processo pode ser repetido.
Polímeros são moléculas gigantes que apresentam unidades que se repetem.
A substância inicial é chamada de monômero e sua repetição 2x, 3x .... nx dá origem ao:
A substância inicial é chamada de monômero e sua repetição 2x, 3x .... nx dá origem ao:
( 2x ) dímero, ......... ( 3x ) trímero ......... ( nx ) polímero - mais de 100 unidades,
Exemplo de dímero:
repetição de duas moléculas do etino (acetileno) produz o butenino.
repetição de duas moléculas do etino (acetileno) produz o butenino.
Exemplo de trímero:
repetição de três moléculas do etino (acetileno) produz o benzeno.
repetição de três moléculas do etino (acetileno) produz o benzeno.
Exemplo de polímero:
repetição de n moléculas do eteno (etileno) produz o polietileno.
repetição de n moléculas do eteno (etileno) produz o polietileno.
Classificação dos Polímeros
1. Quanto à ocorrência:
a) polímeros naturais (os que existem na natureza).
Ex.: proteína, celulose, amido, borracha, etc...
b) polímeros artificiais (obtidos em laboratório).
Ex.: polietileno, isopor (poliestireno insuflado com ar quente), etc ...
a) polímeros naturais (os que existem na natureza).
Ex.: proteína, celulose, amido, borracha, etc...
b) polímeros artificiais (obtidos em laboratório).
Ex.: polietileno, isopor (poliestireno insuflado com ar quente), etc ...
Outros polímeros
Polímeros naturais:.
Borracha natural: polímero de adição do isopreno (metil-butadieno-1,3).
Amido: polímero de condensação da alfa-glicose (com eliminação de água).
Celulose: polímero de condensação da beta-glicose (com eliminação de água).
Proteina: polímero de condensação de alfa-aminoácidos (com eliminação de água).
Amido: polímero de condensação da alfa-glicose (com eliminação de água).
Celulose: polímero de condensação da beta-glicose (com eliminação de água).
Proteina: polímero de condensação de alfa-aminoácidos (com eliminação de água).
Polímeros artificiais:
Plásticos:
Isopor (poliestireno): polímero de adição do estireno / vinil-benzeno (insuflado com ar). Isolante térmico. Quando não expandido é utilizado na fabricação de pratos, copos, etc...
PVC (cloreto de polivinila): polímero de adição do cloreto de vinila / cloro-eteno. Isolante térmico e material usado em estofamentos.
Teflon: polímero de adição do tetraflúor-eteno. Material usado em revestimento de utensílios domésticos.
Plásticos:
Poliisobutileno: polímero de adição do isobutileno (metil-propeno ou isobuteno). Empregado na fabricação de câmaras de ar.
Buna-N: copolímero do acrilonitrila(o) e butadieno-1,3 (eritreno). Empregado na fabricação de pneus.
Fibras:
Poliéster: copolímero de ácidos dicarboxílicos. Empregado na fabricação de tecidos.
Nylon: copolímero de diaminas com ácidos dicarboxílicos. Empregado na fabricação.
Dacron: polímero de condensação entre éster de ácido orgânico com poliálcool do tipo glicol. Empregado na fabricação de velas de embarcações, etc...
Isopor (poliestireno): polímero de adição do estireno / vinil-benzeno (insuflado com ar). Isolante térmico. Quando não expandido é utilizado na fabricação de pratos, copos, etc...
PVC (cloreto de polivinila): polímero de adição do cloreto de vinila / cloro-eteno. Isolante térmico e material usado em estofamentos.
Teflon: polímero de adição do tetraflúor-eteno. Material usado em revestimento de utensílios domésticos.
Plásticos:
Poliisobutileno: polímero de adição do isobutileno (metil-propeno ou isobuteno). Empregado na fabricação de câmaras de ar.
Buna-N: copolímero do acrilonitrila(o) e butadieno-1,3 (eritreno). Empregado na fabricação de pneus.
Fibras:
Poliéster: copolímero de ácidos dicarboxílicos. Empregado na fabricação de tecidos.
Nylon: copolímero de diaminas com ácidos dicarboxílicos. Empregado na fabricação.
Dacron: polímero de condensação entre éster de ácido orgânico com poliálcool do tipo glicol. Empregado na fabricação de velas de embarcações, etc...
Assinar:
Postagens (Atom)